Gracias al aprendizaje automático y a la microscopía de fluorescencia de alto rendimiento se ha conseguido visualizar la maquinaria de reparación del ADN a un detalle nunca antes visto
Tan pronto se produce un daño en el material genético, por ejemplo una rotura de la doble cadena del ADN, la célula activa unos mecanismos de respuesta que funcionan como “una llamada de emergencias”, ejemplifica Bárbara Martínez, autora principal del estudio e investigadora del CNIO. Rápidamente, unas proteínas se unen a esta lesión molecular para enviar señales de alarma, que serán reconocidas por otras proteínas especializadas en corregir el daño.
En busca de mejores terapias contra el cáncer
El objetivo de la quimioterapia es justamente matar a las células tumorales al inducir lesiones en el ADN, que provocan el colapso de las células y su muerte. “Al saber cómo se producen las lesiones en el ADN y cómo se reparan, conoceremos mejor cómo se desarrolla el cáncer y cómo combatirlo. Todo nuevo descubrimiento en la reparación de ADN ayudará a desarrollar mejores terapias contra el cáncer, pero protegiendo nuestras células sanas”, detalla la experta.
Los investigadores han creado una nueva metodología que, con la ayuda de un método de análisis de machine learning diseñado por la Unidad de Confocal del CNIO, permite analizar este proceso con un grado de detalle y precisión nunca antes conseguido. “Hasta la fecha, un factor limitante para el seguimiento en el tiempo de la reparación del ADN era la imposibilidad de analizar la cantidad de datos generados de las imágenes tomadas por el microscopio”.
Al saber cómo se producen las lesiones en el ADN y cómo se reparan, conoceremos mejor cómo se desarrolla el cáncer y cómo podemos combatirlo
Bárbara Martínez, investigadora del CNIO
Para ello, los investigadores han empleado microscopía de fluorescencia de alto rendimiento para realizar miles de fotografías de las células después de inducirles un daño genético. En una primera fase, introdujeron más de 300 proteínas diferentes en las células y evaluaron en un solo experimento si interferían en la reparación del ADN a lo largo del tiempo. Esta técnica ha facilitado el descubrimiento de nueve proteínas inéditas que participan en este proceso.
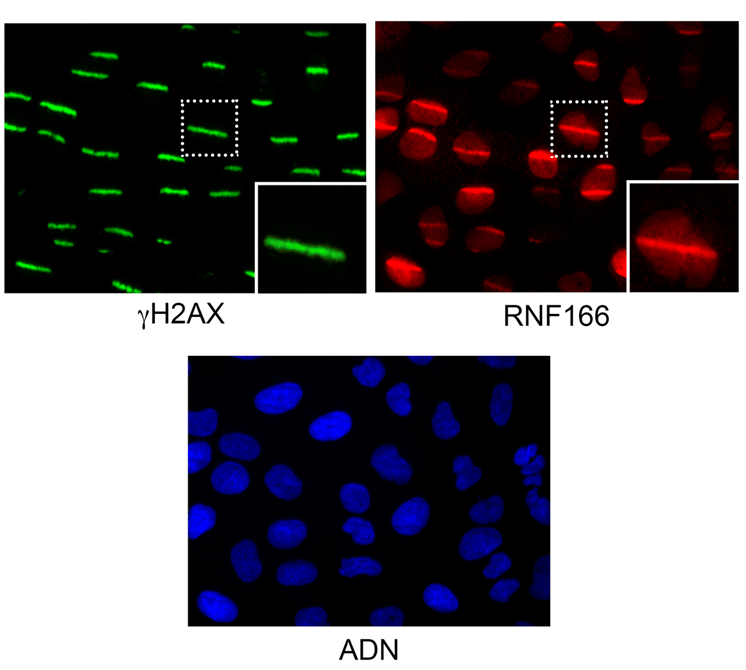
Fotografías de células humanas con el ADN dañado mediante un rayo láser en el laboratorio. En verde, la proteína clásica de reparación H2AX unida a las roturas generadas por el láser; en rojo, la proteína RNF166 descubierta en este trabajo unida a las roturas del ADN, coincidiendo con H2AX; en azul, el ADN celular. / Bárbara Martínez-Pastor (CNIO) y Giorgia G. Silveira (MGH)
Proteínas reparadoras
Posteriormente, los autores decidieron dar un paso más allá y monitorizaron visualmente las 300 proteínas después de generar el daño genético. Para ello, adaptaron una técnica clásica de microirradiación del ADN –que daña este con ayuda de un láser ultravioleta– para usarla a gran escala por primera vez.
“Vimos que muchas proteínas se pegaban al ADN dañado y otras hacían justo lo contrario: se alejaban de las lesiones. Que se unan o se despeguen del ADN dañado para dar paso a otras proteínas reparadoras es una característica común de las proteínas reparadoras del ADN. Los dos fenómenos son relevantes”, explica Martínez.
Las células sin PHF20 –una de las proteínas descubiertas en este estudio– no pueden reparar correctamente su ADN y son más sensibles a la irradiación que las células normales
Estas nuevas tecnologías ofrecen nuevas oportunidades para estudiar la reparación del ADN y su manipulación. “La ventaja es que son métodos muy versátiles que pueden usarse para descubrir nuevos genes o compuestos químicos que afecten a la reparación del ADN, y que utilizan técnicas directas para visualizar fenómenos intracelulares de reparación”, concluye la investigadora.








